Une équipe de chercheurs de l’Université Hébraïque de Jérusalem, de l’Institut Weizmann des Sciences et de l’Université de Tokyo a réalisé une avancée majeure dans la lutte contre le cancer en développant un inhibiteur hautement sélectif pour une enzyme appelée métalloprotéine matricielle 7 (MMP7). Cette enzyme joue un rôle crucial dans la progression du cancer, notamment en aidant les tumeurs à envahir les tissus environnants et à se propager à d’autres parties du corps (métastases). Bien que la MMP7 soit reconnue depuis longtemps comme une cible intéressante pour les thérapies anticancéreuses, concevoir des médicaments capables de la bloquer spécifiquement s’est avéré difficile en raison des similitudes structurelles qu’elle partage avec d’autres enzymes de la famille des métalloprotéines matricielles. Ces enzymes remplissent des fonctions qui se chevauchent, compliquant la conception d’un médicament ciblant uniquement la MMP7 sans affecter les autres.
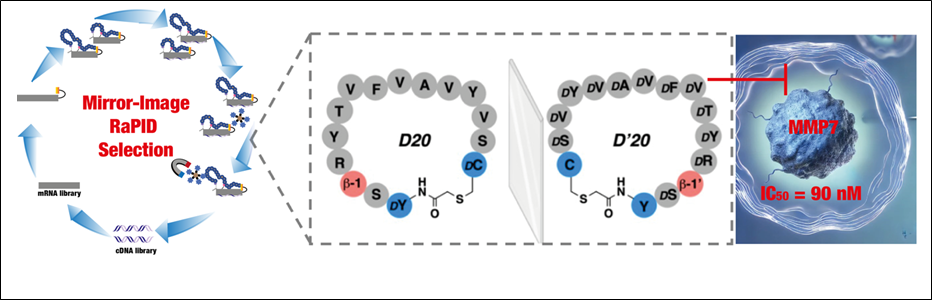
Sous la direction du professeur Norman Metanis et de l’étudiante en doctorat Hiba Ghareeb de l’Université Hébraïque, en collaboration avec la professeure Irit Sagi de l’Institut Weizmann des Sciences et le professeur Hiroaki Suga de l’Université de Tokyo, l’étude a utilisé une approche novatrice appelée découverte intégrée aléatoire de peptides non standards en miroir (MI-RaPID). Cette technologie avancée a permis à l’équipe de recherche d’identifier une nouvelle classe de molécules—appelées peptides macrocycliques—qui se lient spécifiquement à la MMP7, inhibant son activité sans interférer avec des enzymes similaires.
L’un des peptides les plus prometteurs découverts dans cette étude, nommé D’20, a été conçu sous une forme unique en miroir. Ce peptide est composé de douze blocs de construction spécialement modifiés appelés acides aminés D, ainsi que d’autres éléments structurels, ce qui le rend à la fois stable et hautement spécifique. Lors des tests en laboratoire, D’20 a démontré une capacité impressionnante à bloquer l’activité de la MMP7 avec une grande précision, sans affecter d’autres enzymes aux fonctions similaires. De plus, D’20 a arrêté le déplacement des cellules cancéreuses du pancréas, une étape critique pour bloquer les métastases, tout en épargnant la croissance normale des cellules.
La stabilité de D’20 s’est également révélée remarquable : il a conservé sa structure et sa fonction dans le sang humain et dans des conditions simulant le système digestif, ce qui suggère un fort potentiel pour un développement ultérieur en tant que médicament. Cette stabilité est essentielle pour garantir que le peptide puisse agir efficacement dans le corps humain sur une longue durée.
Cette recherche offre non seulement un nouvel espoir pour cibler la MMP7 dans les thérapies anticancéreuses, mais met également en lumière le pouvoir de la technologie de découverte de peptides aléatoires en miroir pour développer de nouveaux traitements. En créant des peptides hautement spécifiques et stables, l’équipe ouvre de nouvelles perspectives pour traiter des cancers agressifs, comme le cancer du pancréas, et améliorer le pronostic des patients atteints de ces maladies difficiles.
L’article de recherche intitulé « Mirror-Image Random Nonstandard Peptide Integrated Discovery (MI-RaPID) Technology Yields Highly Stable and Selective Macrocyclic Peptide Inhibitors for Matrix Metallopeptidase 7 » est maintenant disponible dans Angewandte Chemie et accessible ici.
Chercheurs :
Hiba Ghareeb¹, Choi Yi Li², Anjana Shenoy³, Naama Rotenberg⁴, Julia M Shifman⁴, Takayuki Katoh², Irit Sagi³, Hiroaki Suga² et Norman Metanis¹
Institutions :
- Université Hébraïque de Jérusalem, Institut de Chimie
- Université de Tokyo, Département de Chimie, École Supérieure des Sciences
- Institut Weizmann des Sciences, Département d’Immunologie et de Biologie Régénérative
- Université Hébraïque de Jérusalem, Département de Chimie Biologique, Institut Alexander Silverman des Sciences de la Vie
Un test sanguin simple, mis au point par des chercheurs de l’Université Hébraïque de Jérusalem, pourrait fournir une méthode non invasive pour surveiller les lésions pulmonaires potentiellement mortelles chez les patients prenant des médicaments anticancéreux, évitant ainsi le besoin d’examens réguliers par imagerie.
Selon l’étude publiée dans ESMO Open, les conjugués anticorps-médicaments (ADCs), comme le médicament anticancéreux largement utilisé Enhertu (trastuzumab deruxtecan), représentent une nouvelle génération de thérapies ciblées. Cependant, ces médicaments peuvent parfois provoquer une pneumopathie interstitielle diffuse (PID) — une affection grave pouvant entraîner des lésions pulmonaires importantes si elle n’est pas traitée.
« Les ADCs et d’autres nouvelles thérapies anticancéreuses sont des traitements puissants, mais la surveillance de leurs effets secondaires peut être complexe », a déclaré le Dr Albert Grinshpun de la Faculté de Médecine de l’Université Hébraïque et de l’Institut d’Oncologie Sharett du Centre Médical Hadassah-Université Hébraïque. « Ce test sanguin pourrait offrir une méthode non invasive et peu coûteuse pour détecter précocement les lésions pulmonaires, aidant ainsi les patients à recevoir des soins en temps opportun sans dépendre uniquement des examens d’imagerie. »
Dans cette étude, les chercheurs ont examiné rétrospectivement le sang de patients atteints de cancers HER2-positifs métastatiques traités avec Enhertu, dont certains avaient développé des lésions pulmonaires pendant le traitement. En analysant ces échantillons, l’équipe a détecté des marqueurs de lésions pulmonaires correspondant aux symptômes confirmés par une tomodensitométrie (CT scan).
L’équipe de recherche vise à développer davantage cette méthode pour une utilisation clinique plus large.
L’article de recherche, intitulé « Detection of antibody-drug conjugate-induced interstitial lung disease using circulating cell-free DNA », est maintenant disponible dans ESMO Open et accessible ici.
Chercheurs :
Grinshpun¹,²,³ A., Zick¹,³ T., Perri³,⁴ A., Naim¹ P., Tarantino⁵,⁶ P., Tolaney⁵,⁶ S.M., Magenheim⁷ J., Fridlich⁸ O.
Institutions :
- Institut d’Oncologie Sharett, Centre Médical Hadassah-Université Hébraïque, Jérusalem
- Institut de Recherche sur le Cancer Hadassah et Institut Wohl pour la Médecine Translationnelle, Centre Médical Hadassah-Université Hébraïque, Jérusalem
- Faculté de Médecine, Université Hébraïque de Jérusalem, Jérusalem
- Département de Gynéco-Oncologie, Centre Médical Hadassah-Université Hébraïque, Jérusalem, Israël
- Programme d’Oncologie Mammaire, Dana-Farber Brigham Cancer Center, Boston
- Harvard Medical School, Boston, États-Unis
- Département de Biologie du Développement et de Recherche sur le Cancer, Institut de Recherche Médicale Israël-Canada, Université Hébraïque – École de Médecine Hadassah, Jérusalem
- Centre de Biopsie Liquide au Département d’Hémato-Oncologie Pédiatrique, Centre Médical Hadassah-Université Hébraïque, Jérusalem, Israël